7. 抗菌薬感受性
一部のレンサ球菌にβ-ラクタム系薬耐性菌が出現し始めたとのことですが,感受性の現状はどうなっていますか?
β-ラクタム系薬感受性は,それぞれの菌種について主たる経口用抗菌薬と注射用抗菌薬の最小発育阻止濃度(Minimum Inhibitory Concentration: MIC)のレンジ,MIC50(対象とした50%の菌株の発育を阻止する濃度),MIC90(90%の菌株の発育を阻止する濃度)で示します。参考までにバンコマイシンの成績も示してあります。
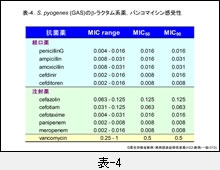
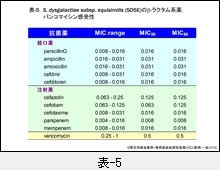
『GAS』は表-4,『SDSE』は表-5に示しますが,両菌に対するβ-ラクタム系薬の抗菌力は比較的優れています。MIC50 と MIC90 が同じ値を示している場合は,MIC は鋭い1峰性分布であることを意味します。また,両菌種には,依然として耐性菌の報告はみられておりません。
しかし,問題もあります。感受性(MIC)の判定は,培養開始から20時間以上経過した時点で行なわれますので,その値が優れているからといって殺菌力も優れているということを意味しているわけではありません。特に,我が国で開発された注射用セフェム系薬の殺菌力は,カルバペネム系薬に較べて明らかに劣っています。重症感染症例に対する抗菌薬の選択時には,その点に留意する必要があります。
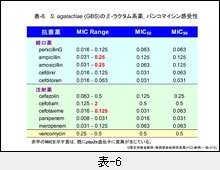
『GBS』の成績は表-6に示します。本菌においては,感受性の低下した軽度耐性株が出現し始めています。表中の GBS 株にも2株認められていますが,これらの株では菌分裂時の隔壁合成酵素(PBP2X,肺炎球菌の耐性メカニズムの項参照)をコードする遺伝子(pbp2x)上に,肺炎球菌の pbp2x 変異株と同様な遺伝子変異が生じています。詳細は既に木村らによって報告されています(Antimicrob. Agents Chemother., 52:2890-2897, 2008)。今後,本菌は pbp2x 以外の遺伝子変異も獲得する可能性が十分考えられます。そうなりますと,β-ラクタム系薬の抗菌力は一段と低下します。
新生児・重症感染症がこのような軽度耐性化した GBS によって惹起されますと,腎機能・肝機能を含めた各種臓器が未熟であるために,治療に難渋することが懸念されます。
なぜ GBS のみがβ-ラクタム系薬耐性を獲得し始めたのですか?
それぞれのレンサ球菌が暴露される薬剤濃度にその原因があるように思われます。
同じβ溶血性レンサ球菌でありながら,GAS と SDSE が分離される検査材料の90%は咽頭や喀痰などです。この事実からも,これらの菌種は呼吸器系に棲息する菌と推測されます。これに対し,GBS はその60%以上が尿,腸管,あるいは生殖器材料から分離されるのです((元)倉敷中央病院検査部,本郷による未公表成績)。
菌が棲息する環境下で暴露される薬剤濃度を考えますと,GAS や SDSE は数μg/mL の薬剤濃度に接触するだけであるのに対し,GBS は極めて高濃度の薬物に触れ,その中で生き延びなければならないことになります。このような厳しい条件下では,それに耐えうる遺伝子変異を獲得した細菌細胞のみが選択され,生き残ってきます。
菌が高濃度の薬剤存在下で生き残る手段としては,① 薬剤を積極的に壊す(超スーパー耐性菌や ESBL などさまざまなβ-ラクタマーゼ),② 薬物を修飾してしまう(アミノ配糖体修飾酵素やマクロライド系薬に対するジメチラーゼなど),③ 複数の遺伝子に変異が生ずる(ニューキノロン系薬耐性など),あるいは④ ひとつの遺伝子に次々と変異が生じ蓄積される,などがあります。
GBS の高度耐性化には,③ あるいは ④ が該当するであろうと考えられています。
レンサ球菌ではマクロライド系薬耐性菌は存在しないのですか?
いいえ,3菌種ともマクロライド系薬耐性菌が分離されています。
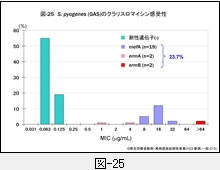
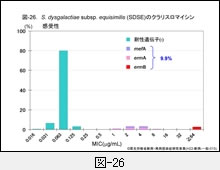
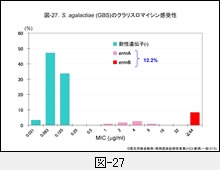
図-25に GAS,図-26に SDSE,図-27に GBS,それぞれに対するクラリスロマイシン(CAM)の感受性成績を示します。他のマクロライド系薬であるエリスロマイシン(EM)やアジスロマイシン(AZM)の感受性パターンもほぼ同様です。
GAS の23.7%がマクロライド系薬耐性,SDSE は9.9%,GBS は12%程度です。レンサ球菌のマクロライド系薬耐性機構は,肺炎球菌のそれと同じ遺伝子によって支配されています。
すなわち,感受性分布の上で 1~32μg/mL に位置する軽度耐性株は,菌体内へ取り込まれた薬剤排出に関わる mefA 遺伝子を保持,高度耐性株ではメチラーゼをコードする誘導型の ermA 遺伝子,あるいは構成型の ermB 遺伝子を保持しています。
ermA 遺伝子保持株は軽度耐性にみえますが,マクロライド系薬に触れますと酵素の産生が誘導され,たちまち高度耐性化します。近年,マクロライド系薬耐性菌は増加傾向にあります。
なお,レンサ球菌による重症感染症に対し,β-ラクタム系薬とクリンダマイシン(CLDM)の併用が推奨されていますが,mefA 保持株はクリンダマイシンに感性ですが,ermB 遺伝子保持株は耐性です。マクロライド耐性菌による重篤な全身性感染症に遭遇した場合,果たしてクリンダマイシンの併用が有効なのか否か,今後の検証が必要と思われます。
ニューキノロン系薬に耐性の GAS が分離され始めたと聞きますが?
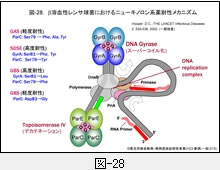
先ず,ニューキノロン系薬耐性化のメカニズムを図-28に模式図で示します。
既にさまざまな菌種においてニューキノロン系薬耐性菌が報告され,問題となっています。いずれも,薬剤の作用標的である i) DNA ジャイレース(GyrA と GyrB の 4量体)をコードする gyrA と gyrB 遺伝子,あるいは ii) トポイソメラーゼ IV(ParC と ParE の4量体)をコードする parC と parE 遺伝子の quinolone resistance-determining region (QRDR)に生じた変異です。特に,gyrA 遺伝子上に変異が生ずると,高度耐性化することが知られています。
ここでは,ニューキノロン系薬の中で最も使用頻度の高いレボフロキサシン(LVFX)の成績を中心に記述します。
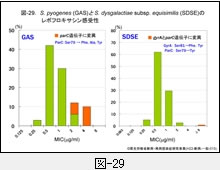
『GAS』に対するレボフロキサシンの感受性分布は図-29(左)に示しますが,遺伝子変異を持たない株でもその MIC は 0.25-2μg/mL です。MIC が正規分布ではなく耐性側にやや偏っていることに気付かれると思いますが,耐性側に位置する 2-4μg/mL の MIC を示す菌株の遺伝子を解析しますと,既に変異が起っており,結果として ParC の79番目のアミノ酸であるセリン(Ser)がフェニルアラニン(Phe)等へ置換しています。
『SDSE』に対するレボフロキサシンの感受性分布も図-29(右)に示しました。ごくわずかですが,32μg/mL 以上の高度耐性株が出現しています。遺伝子変異によるアミノ酸置換は,GyrA の81番目のセリンのフェニルアラニンあるいはチロシンへの置換と,ParC の79番目のセリンのチロシンへの置換が同時に起っています。
今後,GAS や SDSE における耐性化の動向には監視が必要であろうと考えます。
GBS ではさらにニューキノロン系薬耐性菌の頻度が高いとも聞きますが?
その通りです。
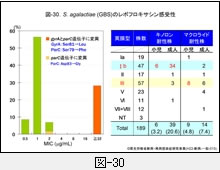
『GBS』の成績は図-30に示しますが,成人の侵襲性感染症由来株の約30%が既にニューキノロン系薬に高度耐性です。これらの株では,やはり GyrA の81番目のセリンがロイシン(Leu)へ,ParC の79番目のセリンもフェニルアラニンへ置換しています。
しかも,同図にみられるように,耐性株はそのほとんどが莢膜 Ib 型なのです。
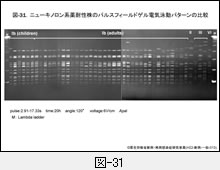
図-31に示すパルスフィールド・ゲル電気泳動による DNA プロファイルでも, Ib 型はほとんどが同一です。これらの成績をみますと,ニューキノロン系薬に耐性化した莢膜 Ib 型のクローンが全国へ拡散したのか,あるいは Ib 型の GBS が耐性を獲得しやすいのか,そのいずれかであろうと思われます。
【基礎研究者からのコメント】
本来,ニューキノロン系薬はグラム陰性桿菌に優れた抗菌力を有する薬剤です。近年開発されているレスピラトリーキノロン系薬は,側鎖の化学構造に新規性を持たせ,グラム陽性球菌である肺炎球菌やレンサ球菌に対する抗菌力を増強しています。セフェム系薬の開発経緯と同様に,みかけの感受性(MIC)は良くなりましたが,殺菌性まで改良されたわけではないように思われます。
成人の呼吸器系感染症に対して本系統の薬剤が繁用されていますが,外来受診例でグラム陽性球菌感染症が強く疑われる症例やハイリスク症例に対しては,抗菌薬の慎重な選択が望まれます。