薬剤感受性(phenotype)と遺伝子型(genotype)
現在,β-ラクタム系薬耐性菌はどの位の割合で認められるのでしょうか?
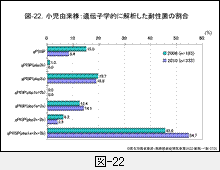
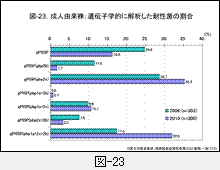
2010年度の侵襲性感染症由来株について,遺伝子解析による耐性株の割合を小児は図-22,成人は図-23に示します。
2006年の小児の成績ではgPRSPの割合は45.6%であったのですが,2010年には54.7%へと漸増しています。後述する小児用肺炎球菌結合型ワクチン(PCV7)はこれらの耐性菌をほとんどカバーしています。
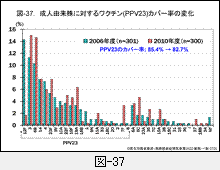
一方,成人由来株についての2010年の成績では,2006年に比べ有意にgPRSPが増加,17.5%から32.0%とほぼ倍増しています。加えて,gPISP(pbp2x)が多いのですが,これらの変化は莢膜型の変化と連動しています(莢膜型の図-37参照)。
遺伝子解析の結果は検査室の感受性報告と一致しているのでしょうか?
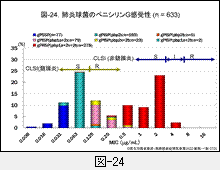
関連しているのですが,解釈が異なることに留意が必要です。図-24には,寒天平板希釈法で正確に測定されたペニシリンG感受性(MIC)と,遺伝子解析の結果を重ねた成績を示します。前者の生物学的手法による結果はphenotype(表現型),後者はgenotype(遺伝子型)といいます。ちなみにMICとは最小発育阻止濃度のことで,菌がその濃度に触れれば菌の発育が停止する濃度です。必ずしも菌が死滅しているわけではありません。
生物学的手法による感受性(MIC)分布をみますと,非常に曖昧な2峰性分布です。β-ラクタマーゼ産生菌と非産生菌で明瞭に感受性分布が区別できるグラム陰性桿菌と,このような「質的変化による耐性菌」が大きく異なる点です。
しかし,遺伝子変異別の分布をみますと,それぞれの90%は薬剤希釈濃度3段階以内にほぼ収まっていることが判ります。たとえば,gPISP(pbp1a+2x)の株は0.125 μg/mL~0.5 μg/mLの感受性です。つまり,遺伝子変異を明らかにすると,その結果から感受性(MIC)が容易に推定できるのです。PBP遺伝子の変異が重なるほど感受性は低下,すなわち耐性化しています。
ちなみに,2010年度収集株では,gPRSP(pbp1a+2x+2b)株は43.9%,gPISP(pbp1a+2x,pbp2x+2b)株は16.1%, gPISP(pbp2x,pbp2b)株は27.5%であり,gPSSP株はわずか12.2%にしか過ぎませんでした。
それでは,CLSIのブレイクポイントはどのように解釈すればよいのでしょうか?
Clinical and Laboratory Standards Institute(CLSI: USA)のブレイクポイント(BP),すなわち感性(Susceptible:S)/中間(Intermediate:I(本来どちらとも取れる濃度という意味))/耐性(Resistance:R)の濃度を 図-24 に併記しました。
いわゆるCLSIでは3点表記なのですが,これらは米国で認可されている薬物投与量における臨床効果の成績から算出されたものです。分離菌の感受性と臨床効果に関するエビデンスが蓄積されてきますと,しばしばBPが変更されることになります。つまりは,遺伝子学的にgPRSPであっても投与量を増やせば効くという理論です。
確かにもっともな理屈です。このためにCLSIでは疾患(厳密には病巣)を重視し,肺炎球菌感染症を”非髄膜炎(肺炎や敗血症など)”と”髄膜炎”に分けてBPを設定しています。β-ラクタム系薬が高濃度に移行しやすい敗血症,あるいは肺炎の場合には,2 μg/mL 以下の菌は臨床的な”S”,4 μg/mL は“I”,8 μg/mL以上が”R”となっています。
しかし,化膿性髄膜炎では0.063 μg/mL以下のMICを示す菌のみが“ S”,0.125 μg/mL以上は”R”とみなして治療をするようにとリコメンドされています。特に,乳幼児の化膿性髄膜炎では分離菌の感受性(MIC)の10倍以上の十分な髄液中薬物濃度,ならびに菌に対する殺菌力が必要とされています。
化膿性髄膜炎に使用される機会の多い薬剤のBPはどのように設定されていますか?
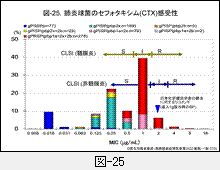
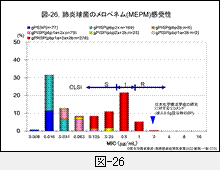
化膿性髄膜炎例に使用される機会の多いセフォタキシム(CTX)とメロペネム(MEPM)の薬剤感受性分布と,CLSIのBPを図-25と図-26に示します。
CTXでは非髄膜炎と髄膜炎に分けてBPが設定されていますが,MEPMは区別されていません。
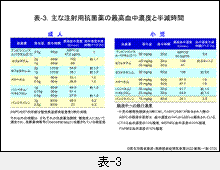
これらの薬剤の日本人での血中濃度等は表-3にまとめてありますので参考にしてください。
なお,図中には我が国において日本化学療法学会が治験時の成績を元に肺炎に提唱している臨床的ブレイクポイントを示してあります(Chemotherapy,42(8),1994)。このBPは80%の有効率が得られると推定される1濃度表記です。日本では当時疾患別にBPが設定されましたが,その算出根拠は薬剤の体内動態を重視した計算式から算出され,臨床に適したものとなっていたはずです。しかし,これも耐性菌が増加していますので再度評価する必要があるかと思います。
要は,感染症の重症度に加え,薬物の移行が比較的よい生体部位の感染症なのか,移行の悪い部位に生じた感染症なのかで考え方が異なるということです。
抗菌薬の臨床効果にはどのような要因が影響するのでしょうか?
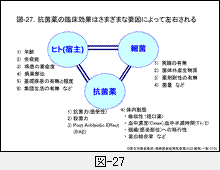
感染症に対する抗菌薬の臨床効果は,ヒト(宿主) = 細菌 = 薬剤の関係を常に考える必要があります。疾患と薬剤の関係のみを考えるものとは根本的に異なるのです。
図-27には,臨床効果に影響するさまざまな要因(ファクター)の中から主なものを示しましたが,それぞれに多くの要因があり,一筋縄ではいきません。現在,集積されてきているそれぞれの症例に関するアンケートを拝見しますと,宿主がどのような病態にあるのかが薬剤の臨床効果を最も左右する要因のように思います。
従来,抗菌薬の選択は感受性の優劣のみを指標としがちでしたが,図からも判るように感受性は薬剤の単なる指標のひとつにしか過ぎません。むしろ殺菌性に優れること,PAE(Post Antibiotic Effect)の有無,そしてPharmacokinetics/Pharmacodynamics(PK/PD,薬物動態学/薬力学)が重要視されています。
その他に重要な点として,CLSIの判定基準をそのまま我が国の臨床へ当てはめることはできないということがあります。なぜかといいますと,抗菌薬の投与量が異なるからです。我が国の通常投与量は米国のそれよりも一般に少ないのですが,それは日本人の体型をベースにした新薬治験時の成績に基づいて設定されているからです。これには副作用の問題も絡んでいます。
耐性菌が増加した今日,投与量の再考は必要ですが,単に米国の基準を日本人へあてはめるのではなく,体型の異なる日本人で臨床効果に関する再評価を行ない,改めて投与量を決定する必要があります。
gPRSPに対する注射用抗菌薬の抗菌力にはどの程度の差があるのですか?
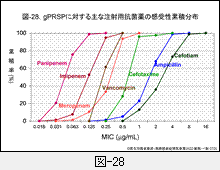
我が国で使用頻度の高い主な注射用抗菌薬のgPRSPに対する感受性累積分布は図-28に示します。
図からも明らかなように,抗菌力が優れているのはカルバペネム系薬です。中でもパニペネム(PAPM,米国には導出されていないのでCLSIに記載がない)は0.063 - 0.125 μg/mLと最も優れています。我が国でも使用頻度の高いMEPMは0.125 – 1 μg/mLとやや劣ります。
第三世代セフェム系薬のCTXとセフトリアキソン(CTRX,重なるのでここには示さない)の抗菌力は0.5 – 2 μg/mLとほぼ同じです。セフォチアム(CTM)に代表される日本で開発されたセフェム系薬の肺炎球菌に対する抗菌力は,一般的に劣っています。
参考までに,表-3に主な抗菌薬の成人と小児における最高血中濃度(Cmax)とその半減時間(T1/2)を示します。
gPRSPに対する殺菌力を比較した成績はあるのでしょうか?
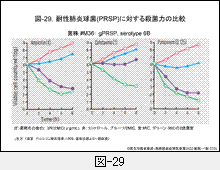
図-29にPRSPに対するアンピシリン(ABPC),CTX,およびPAPMの経時的殺菌効果を示します。
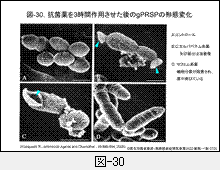
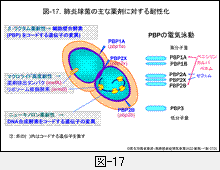
薬剤の種類によって殺菌力には明らかな違いがみられますが,この結果はそれぞれの薬剤が活性を阻害する細胞壁合成酵素の種類を反映しています。それは図-30に示す薬剤作用後の形態変化からも確かめられ,PBP1AとPBP2Bに結合するPAPMやABPCは短時間で溶菌するのに対し,PBP2Xに結合する薬剤の殺菌性は劣ります(図-17参照)。
ちなみに,最も汎用されているMEPMは,PAPMとCTXのちょうど中間の結果を示すことが判っています。
gPRSPに対する経口抗菌薬の抗菌力はどの程度なのでしょうか?
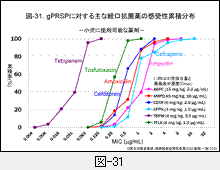
我が国で使用されている主な経口抗菌薬のgPRSPに対する感受性累積分布は,図-31に示します。
経口抗菌薬では,それぞれの薬剤を服用した際に腸管から吸収されて得られる血中濃度,さらには炎症を起こしている組織への移行濃度が重要です。各薬剤名に続くカッコ内に投与量と最高血中濃度(Cmax)を示してあります。
例えば,アモキシシリン/クラブラン酸(AMPC/CVA)はセフェム系薬に較べて投与量も多く,高い血中濃度が得られます。累積分布がほぼ同じであれば,吸収性に優れる薬剤の方が臨床効果は期待できることになります。
最近,小児における耐性菌感染症(PRSPとBLNAR)用として,テビペネム(TBPM,カルバペネム系薬)とトスフロキサシン(TFLX,ニューキノロン系薬)が承認されましたが,通常投与量で得られる血中濃度や短時間殺菌性には明らかな違いがあります。
経口抗菌薬の選択については,「小児呼吸器感染症診療ガイドライン2011(小児呼吸器感染症診療ガイドライン作成委員会編,協和企画)を参照ください。
経口用マクロライド系薬が多く使用されていますが,耐性菌はどの程度存在するのですか?
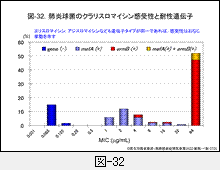
図-32にマクロライド系薬(ML)の中からクラリスロマイシン(CAM)の感受性分布を示しますが, ML耐性菌の割合は80-85%と非常に高いのです。CAMのみならず,エリスロマイシン(EM),アジスロマイシン(AZM)も同様の成績です。
耐性メカニズムの項で示しましたが,MLの作用標的はリボソームです。耐性菌ではermB遺伝子にコードされたリボソーム修飾酵素を産生し,高度耐性化しています(図-17参照)。
もうひとつは,菌体内へ取り込まれたMLを排出するタンパクを保持する菌です。mefA遺伝子にコードされたこのタンパクを細胞膜上に持つ菌は,EM,CAM,AZMに1 – 8 μg/mLの感受性を示すようになります。
これらの薬剤もまた,服用後の血中への吸収はそれほど優れていません。ただし扁桃や肺細胞中の濃度は高いといわれています。
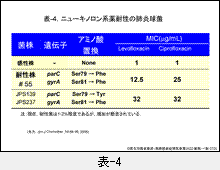
経口用ニューキノロン系薬も多く使われていますが,耐性菌は存在するのですか?